
Wageningen World
CRISPR-Cas-pionier John van der Oost: ‘Mijn wetenschappelijke loopbaan hing van toevalligheden aan elkaar’
Toen John van der Oost jaren geleden in Wageningen aankwam had niemand nog van CRISPR-Cas gehoord – ook hijzelf niet. De route naar de ontdekking van deze revolutionaire technologie werd bepaald door toeval en kansen pakken wanneer die zich aandienden. Dit jaar gaat hij met pensioen.
Tekst: Albert Sikkema | Fotografie: Eric Scholten
De weg van microbioloog John van der Oost naar de ontdekking van de genetische knip- en plaktechniek CRISPR-Cas was lang en kronkelig. ‘Mijn wetenschappelijke loopbaan hangt van toevalligheden aan elkaar’, zegt hij. Dat begon al bij zijn studiekeuze: ‘Vlak voor mijn vwo-eindexamen las ik in ons biologieboek een hoofdstuk dat de docent had overgeslagen. Dat ging over moleculaire biologie, over hoe organismen informatie opslaan in het DNA en die via RNA omzetten in eiwitten.'
Wageningen World
'Dat vond ik zo fascinerend dat ik besloot om biologie te gaan studeren. Ik was in die tijd lid van de PSP, de Pacifistisch Socialistische Partij, dus het lag voor de hand dat ik aan de progressieve Universiteit van Amsterdam ging studeren. Maar ik dacht dat de progressieve universiteit de Vrije Universiteit was, haha, dus heb ik me daar ingeschreven. Daar bleken sommige docenten hun college te beginnen met een stukje uit de Bijbel. Toch voelde het als een heel goede plek, dus ben ik er gebleven.’
Voor zijn specialisatie koos hij niet, zoals de meeste studievrienden, voor onderzoek naar dieren. ‘Ik was vegetariër geworden en wilde geen dieren doden voor onderzoek. Ik wilde vakken doen bij plantenfysiologie, maar die zaten vol. Zij zeiden: kijk eens bij microbiologie.’
Dat bleek interessant en Van der Oost ging aan de slag met onderzoek naar de energieproductie door bacteriën. In 1984 kreeg hij een promotieplaats aan de VU, waarin hij bestudeerde hoe cyanobacteriën zonlicht omzetten in waterstof. ‘Dat was pionierswerk. Zo bleken we in Amsterdam niet over de geschikte cyanobacteriën te beschikken, dus ben ik met mijn vriendin Paulien naar Parijs gelift. Uit de cultuurcollectie van het Pasteur-instituut kreeg ik de gewenste cyanobacteriën, die in reageerbuisjes in mijn rugzak mee terug gingen.’
Tegenwoordig kan een gen in een paar dagen geanalyseerd worden, ik was er een jaar mee bezig
Van der Oost pakt zijn proefschrift uit de kast. Hij beschreef niet alleen onder welke condities de bacteriën waterstof gingen maken, maar ook een belangrijk gen dat daarvoor verantwoordelijk is. Hij slaat de betreffende pagina’s open, vol met de letters van het DNA, de GATC-codes. ‘Kijk, dit is het gen – niet minder dan 1500 baseparen. Tegenwoordig kan een gen in een paar dagen geanalyseerd worden, maar ik was er wel een jaar mee bezig. Toen ik eraan begon, zeiden mijn begeleiders: dat lukt je nooit.’
Nadat een beursaanvraag voor vervolgonderzoek in Brighton niet wordt gehonoreerd, komt hij via omzwervingen – een half jaar bij de universiteit van Helsinki en 2,5 jaar op een instituut in Heidelberg – weer terug bij de VU. Maar niet voor lang: de groepsleider bij Microbiologie die een vaste baan voor hem wilde regelen, overlijdt in het lab aan een hartstilstand. Zijn opvolger blijkt andere plannen te hebben, dus er gaat een streep door de baan. ‘Dat was even slikken, want ik was intussen met Paulien getrouwd en we hadden drie kinderen.’ Hij reageert op vacatures voor een microbioloog op verschillende locaties in Nederland en wordt in Wageningen aangenomen door hoogleraar Willem de Vos.

Als Van der Oost dertig jaar geleden, dan 37 jaar oud, in Wageningen arriveert, heeft niemand nog van CRISPR-Cas gehoord, ook hijzelf niet. Hij wordt leider van de onderzoeksgroep Bacteriële Genetica. ‘De eerste tien jaar richtten we ons op de evolutie van archaea en bacteriën, relatief simpele micro-organismen zonder celkern, tot eukaryoten; organismen met een celkern, van schimmels tot mensen. We onderzochten met name welke eiwitten uit archaea zijn terechtgekomen in eukaryoten. Daar kwamen mooie onderzoeksresultaten uit en in 2005 kreeg ik een prestigieuze Vici-beurs van NWO, waarmee ik het onderzoek verder kon uitbouwen.’ Kort daarna werd hij gepromoveerd tot persoonlijk hoogleraar. ‘Thijs Ettema, de huidige hoogleraar Microbiologie – officieel mijn baas dus – zat als student bij me in de collegezaal. Hij heeft de afgelopen jaren belangrijke puzzelstukjes gelegd in dit fundamentele onderzoek.’
Wanneer kwam CRISPR-Cas in beeld?
‘In september 2005 promoveerde Thijs Ettema. Een van de leden van de promotiecommissie was bio-informaticus Eugene Koonin. Hij vertelde voor het eerst over Clusters of Regularly Interspaced Short Palindromic Repeats (CRISPR), repeterende stukjes DNA in het genoom van bacteriën. Wij hadden in 2001 ook zulke CRISPR-stukjes gevonden, maar we hadden geen idee van hun functie. De Spanjaard Francisco Mojica had ontdekt dat de variabele DNA-stukjes in CRISPR vaak identiek waren aan stukjes DNA van bacteriofagen, virussen die bacteriën als hun gastheer gebruiken. Hij bedacht dat CRISPR misschien wel onderdeel was van een afweersysteem van bacteriën tegen bacteriofagen. Koonin vertelde ook dat zijn groep clusters aan CRISPR gekoppelde genen had ontdekt, die waarschijnlijk codeerden voor eiwitten die betrokken zijn bij het afweersysteem, zogenoemde Cas-eiwitten.
Samen met postdoc Stan Brouns, sinds vorig jaar hoogleraar in Delft, besloot ik een poging te wagen om het CRISPR-Cas systeem verder te ontrafelen. Toen heb ik mijn Vici-project helemaal omgegooid, van archaea naar CRISPR-Cas. Ik heb onderzoekfinancier NWO later een brief gestuurd: sorry, ik heb het grootste deel van mijn beurs gebruikt om iets heel anders te onderzoeken. Daar heb ik nooit een reactie op gehad, ik neem aan dat ze het een goede beslissing vonden.’
Wat was het resultaat?
‘In 2008 beschreven we de eerste inzichten over de werking van CRISPR-Cas in een publicatie in Science. Dat was echt een doorbraak, een van de meest spectaculaire publicaties in mijn loopbaan. Dit artikel wordt beschouwd als een mijlpaal in het CRISPR-veld, en is al ruim drieduizend keer geciteerd.’
Wanneer veranderde fundamenteel onderzoek aan bacteriën in een gereedschap om DNA aan te passen?
‘Er was in die tijd een onderzoeksteam van zuivelbedrijf Danisco dat probeerde te begrijpen hoe melkzuurbacteriën zich beschermen tegen bacteriofagen. Ze deden een experiment waarin ze een bacteriofaag toevoegden aan een reactor met melkzuurbacteriën. De bacteriecultuur klapte in elkaar, omdat de bacteriecellen werden gedood door de virussen. Maar na een dag begon de bacteriecultuur weer te groeien. Dat kwam omdat er een paar bacteriën resistent waren geworden tegen de bacteriofaag.
Toen de onderzoekers het CRISPR-DNA van deze overlevende melkzuurbacteriën analyseerden, bleek dat er stukjes virus-DNA waren ingebouwd. Die aanpassing zorgde ervoor dat de bacterie kon overleven in aanwezigheid van het virus. Toen ze het stukje virus-DNA uit de CRISPR verwijderden, werd de bacterie weer gevoelig voor het virus. Dit was het bewijs dat het CRISPR-systeem een adaptief afweersysteem is, dat zich kan aanpassen en heel specifiek virussen kan herkennen en uitschakelen.
Maar de grote vraag was: hoe werkt dat allemaal? Na het bezoek van Koonin hadden wij besloten om het CRISPR-Cas-systeem van de modelbacterie E. coli te bestuderen. In het CRISPR-DNA van deze bacterie vonden we helaas geen match met het DNA van bekende bacteriofagen. Daarom besloten we om zelf stukjes van een specifieke E. coli-bacteriofaag in het CRISPR-DNA van de bacterie in te bouwen. Daarmee hadden we de eerste design-CRISPR gemaakt, en die gingen we testen.
Als we aan een voedingsbodem met onaangepaste E. coli-bacteriën de bacteriofaag toevoegden, ontstonden gaten in het bacteriedek, doordat de bacteriën op die plekken de virusinfectie niet overleefden. Voegden we de bacteriofaag bij onze aangepaste designer-E. coli, dan vonden we geen gaten. Dat was het eureka-moment: we konden heel gericht een bacterie beschermen tegen een bacteriofaag, we noemden het “een griepprik voor bacteriën”. In de jaren daarna is door verschillende onderzoeksgroepen stap voor stap het complete mechanisme van het CRISPR-Cas systeem opgelost.’
Wanneer werd het business?
‘Stan Brouns bedacht dat ons CRISPR-systeem wellicht veel breder toegepast kon worden, als een nieuw instrument voor genome editing; om het DNA van planten en mensen bewust en gericht aan te passen. Samen hebben we de potentie van CRISPR-Cas uitgelegd aan Paul van Helvert, de octrooideskundige van WUR, en met zijn drieën zijn we naar een patentbureau in Londen gegaan om de mogelijkheden te bespreken. In 2011 dienden we een octrooiaanvraag in, waarin we beschreven hoe we gericht wijzigingen konden aanbrengen in elk DNA, dus ook in dat van planten en mensen.’
Je stond aan de basis van onderzoek dat later goed was voor de Nobelprijs.
‘Emmanuelle Charpentier en Jennifer Doudna, die in 2020 de Nobelprijs voor Scheikunde kregen voor de ontwikkeling van de CRISPR-Cas9-techniek, beschreven hetzelfde mechanisme in 2012, een jaar later dan wij. Maar zij gebruikten een ander systeem, het Cas9-eiwit van een melkzuurbacterie. Dat systeem was heel compact en eenvoudig, terwijl ons systeem complex was, met een cascade van twaalf betrokken eiwitten, wat dus veel moeilijker te gebruiken was als instrument voor genome editing.’
Waarom gingen jullie dan patenten aanvragen?
‘We wisten in 2011 uiteraard niet dat Cas9 zoveel beter zou gaan werken. En we werden vanuit de organisatie gestimuleerd om onze vindingen en ideeën te beschermen. Een octrooiaanvraag is speculeren, het is allemaal behoorlijk onvoorspelbaar of het een goede investering is. Maar een patent wordt ook gezien als een publicatie die mogelijk je cv en onderzoeksvoorstellen kan versterken. Het was dus een strategische keuze om spannende ideeën te beschermen via patenten. Ik heb de afgelopen vijftien jaar ruim dertig patenten ingediend.’
Wat hebben die opgeleverd?
‘De meeste patenten hebben alleen maar geld gekost, maar een paar hebben geld opgeleverd, met name het patent op Cas12. Het is een mooi verhaal hoe dat is gelopen. Op een congres in Parijs sprak ik een medewerker van eerdergenoemde Koonin, die zei: we hebben een nieuw CRISPR-systeem ontdekt, Cas12, daar moet je aan gaan werken. Na een paar maanden hadden we de eerste resultaten: Cas12 bleek inderdaad heel anders te werken dan Cas9. Ik besloot een projectvoorstel in te dienen om hier meer mensen aan te laten werken, maar dan moest ik wel opschrijven wat ik al wist en wat ik allemaal van plan was. Toen hebben octrooideskundige Van Helvert en ik besloten om, hoewel we nog lang niet alle details van Cas12 hadden opgehelderd, toch alvast een octrooiaanvraag in te dienen.
Een paar maanden later ontmoette ik moleculair bioloog Feng Zhang van het Broad Institute uit Boston op de jaarlijkse CRISPR-meeting. Het bleek dat hij dezelfde tip van Koonin had gekregen, en dus ook aan Cas12 werkte. We besloten om te gaan samenwerken. Het team van Zhang was al heel ver, en ook het Broad Institute had patent aangevraagd, maar wel zes weken na onze indiening. We hebben toen afgesproken onze patenten gezamenlijk te beheren.’
Waarvoor wordt Cas12 gebruikt?
‘Cas12 kan worden gebruikt om bepaalde humane ziekten te genezen. Een prachtig voorbeeld is het genezen van chronische bloedarmoede, veroorzaakt door een erfelijke mutatie in het hemoglobine in de rode bloedcellen. Cas12 kan die bloedcellen repareren door een stukje DNA aan te passen. Daarnaast wordt Cas12 gebruikt om planten resistent te maken tegen ziekten.’
Waar gaan de patentinkomsten naartoe?
‘Het geld gaat voor een deel naar de uitvinders, deels naar de leerstoelgroep Microbiologie en voor de rest naar de Agrotechnology & Food Sciences Group (AFSG) van WUR. Willem de Vos en ik hebben afgesproken dat dat laatste deel in een soort fonds gaat, het Innovation Platform Microbiology. Onderzoekers van AFSG kunnen uit dit fonds geld aanvragen voor het opzetten van vernieuwend microbiologisch onderzoek. Het is een revolving fund, hartstikke mooi.’
Heb je meer patenten die nu worden toegepast?
‘In 2015 deden we onderzoek naar bacteriën die cellulose van plantafval kunnen afbreken, zodat dat afval beter gerecycled kan worden. We zochten in een composthoop in de omgeving van Wageningen en vonden twee kandidaten. Toen we het genoom van deze bacteriën in kaart brachten, vonden we een alternatief Cas9-systeem. Ook daar hebben we een aantal patenten op aangevraagd. Enkele maanden later zag ik Christa Testerink, hoogleraar Plantenfysiologie, bij een wetenschapsprogramma op tv vertellen over haar werk aan zouttolerante rijstgewassen in Wageningen en bij het International Rice Research Institute (IRRI) in de Filippijnen. Toen dacht ik: waarom stellen we deze patenten niet gratis beschikbaar voor dat soort non-profitprojecten, zodat ze planten kunnen aanpassen aan een veranderend klimaat? Het universiteitsbestuur moest als patenthouder ook toestemming geven. Gelukkig was Louise Fresco, destijds bestuursvoorzitter, ook enthousiast. We hebben dit plan gelanceerd bij de opening van het academisch jaar in 2021.’
Hebben jullie al resultaten?
‘Onlangs zijn Christa en ik met geld van donoren, via het University Fund Wageningen, een project gestart met het IRRI. Met dit systeem is het in Christa’s groep onlangs voor het eerst gelukt om DNA van rijstplanten te veranderen. Om de zouttolerantie van de rijstplant te verhogen, moeten we een aantal genen aanpassen. Deze kennis gaan we binnenkort delen met het IRRI.’
Toen het patent werd vrijgegeven in 2021, stond Extinction Rebellion te protesteren bij de Aula en hotel De Wereld. Jij wilde met hen praten, maar ze zeiden niets. Je werd erg boos.
‘Ja, wij als onderzoekers krijgen vaak het verwijt dat we onze kennis gebruiken om bedrijven te helpen. Nu gaven we een keer onze kennis gratis weg om de wereld beter te maken en dan staan ze met maskers te demonstreren. Dat frustreerde me enorm, want ik ben het heel vaak eens met Extinction Rebellion, en ik sta ook weleens op het punt om me vast te lijmen op de A12 voor een beter klimaat. Ik wilde dus met ze in gesprek over hoe onze technologie en onze kennis de wereld ook beter kunnen maken. Maar dat kon niet. Daarover was ik erg teleurgesteld.'
Technologie en patenten zijn niet per definitie foute boel
'Technologie en patenten zijn niet per definitie foute boel, het hangt ervan af wat je ermee doet. Je kunt de technologie ook gebruiken om de voedselproductie op een duurzame manier te verhogen. Ik denk dat ik wat dat betreft niet veel veranderd ben sinds ik in Amsterdam PSP-posters liep te plakken.’
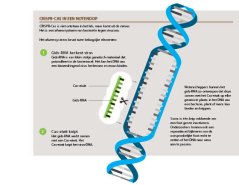
CRISPR-Cas in een notendop
CRISPR-Cas is niet ontstaan in het lab, maar komt uit de natuur. Het is een afweersysteem van bacteriën tegen virussen.
Het afweersysteem bevat twee belangrijke elementen:
Gids-RNA herkent virus
Gids-RNA is een klein stukje genetisch materiaal dat patrouilleert in de bacteriecel. Het kan het DNA van een binnendringend virus herkennen en eraan binden. Wetenschappers kunnen het gids-RNA zo ontwerpen dat deze samen met het Cas-eiwit op elke gewenste plaats in het DNA van een bacterie, plant of mens kan binden en knippen.
Cas-eiwit knipt
Het gids-RNA werkt samen met een Cas-eiwit. Het Cas-eiwit knipt het virus-DNA. Soms is één knip voldoende om een fout gen te inactiveren. Onderzoekers kunnen ook een reparatieset bijleveren om de oorspronkelijke fout recht te zetten of het DNA naar wens aan te passen.
John van der Oost (67)
Hij zoekt veelvuldig contact met het grote publiek en is wetenschappelijk adviseur van de bedrijven NTrans Technologies, Scope Biosciences en Hudson River Biotechnology.
1984: MSc Moleculaire Biologie, VU
1989: Promotie VU
1995: Laboratorium voor Microbiologie, WUR
2005: Persoonlijk hoogleraar Bacteriële Genetica, WUR
2008: Eerste CRISPR-Cas-publicatie in Science
2013: Lid European Molecular Biology Organization
2017: Lid Koninklijke Nederlandse Akademie van Wetenschappen
2018: Winnaar NWO-Spinozapremie
2025: Winnaar M.W. Beijerinck Virologie Prijs
